Perché i requisiti di imballaggio e conservazione USP <659> sono importanti?
USP <659> Le modifiche si stanno avvicinando rapidamente
La Farmacopea degli Stati Uniti (USP) ha programmato modifiche ai capitoli chiave che potrebbero interessare le società del settore farmaceutico come produttori, grossisti e farmacisti, insieme a tutte le società che gestiscono, immagazzinano e trasportano prodotti farmaceutici, compresi i fornitori di servizi logistici. Le modifiche saranno pubblicate nell’agosto 2020 e rese effettive entro dicembre 2020. In questa serie metteremo in evidenza importanti cambiamenti che influenzeranno lo stoccaggio e la distribuzione delle società farmaceutiche e come pianificare tali cambiamenti.
Differenza tra orientamento e legge
Fondata nel 1820 a Washington, DC, l’USP è un’organizzazione scientifica senza scopo di lucro che sviluppa e diffonde standard di qualità di compendi pubblici per medicinali e altri articoli. La definizione della temperatura del prodotto USP era originariamente in USP <1079> e ora risiede nel capitolo USP <659>. Ciò è significativo, perché i capitoli con un numero superiore a 1.000 sono considerati una guida, mentre quelli con un numero inferiore a 1.000 sono considerati legge e sono applicabili dalla Food and Drug Association (FDA) degli Stati Uniti. Lo spostamento delle definizioni di temperatura del prodotto in USP <659> ha legalmente imposto che tutti i prodotti con dichiarazioni relative all’etichetta della temperatura debbano garantire il mantenimento della temperatura.
Aggiunta della definizione Freddo Controllato
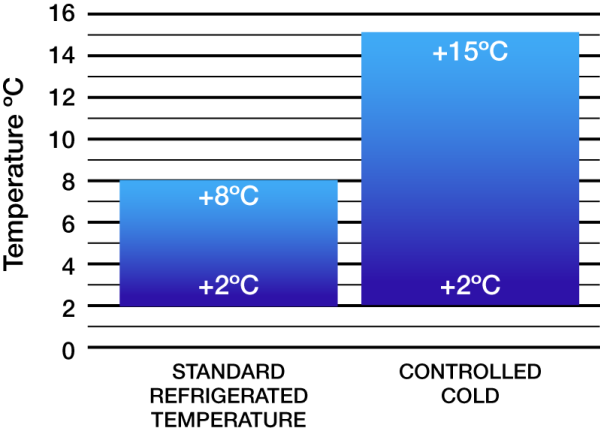
L’USP ha aggiunto una nuova definizione di temperatura chiamata Freddo Controllato. La temperatura refrigerata standard è compresa tra +2°C e +8°C. La definizione aggiunta di Freddo Controllato è compresa tra +2°C e +15°C con tempo di escursione della temperatura (oltre i limiti) non superiore a 24 ore e temperatura cinetica media (MKT) non superiore a +8°C. Non sono consentite escursioni inferiori a +2°C o superiori a +15°C.
Temperatura refrigerata standard vs. Freddo Controllato
Per comprendere ulteriormente MKT, è definito in (USP 35 Capitolo <1150>, Stabilità farmaceutica) come: “… una singola temperatura calcolata alla quale la quantità totale di degradazione in un determinato periodo è uguale alla somma dei singoli degradi che si verificano a varie temperature.” Ad esempio, si suppone che il valore MKT includa la quantità totale di degradazione del prodotto per un periodo di tempo equivalente alla degradazione incrementale che si verificherebbe in escursioni separate. MKT è uno strumento aggiuntivo che può essere utilizzato per valutare un’escursione di temperatura.
Questa nuova definizione di Freddo Controllato consentirà di valutare più rapidamente i prodotti refrigerati che subiscono escursioni termiche. La precedente definizione più rigida da +2°C a +8°C richiedeva la quarantena e la valutazione di più spedizioni. Le aziende possono valutare potenziali risparmi sui costi riducendo il numero di spedizioni con escursioni, riducendo il tempo del Quality Assurance dedicato a studiare le escursioni.
I datalogger TempTale® possono essere programmati a una temperatura compresa tra +2°C e +15°C con MKT a +8°C per ridurre potenzialmente il tempo di indagine sulle escursioni.
I due cambiamenti in USP <659> mostrano che la FDA sta continuando a orientarsi verso un’applicazione più rigorosa per proteggere i consumatori, mentre allo stesso tempo definisce i modi per rendere più efficiente il processo di gestione delle escursioni.
Sensitech® Inc. tiene traccia e mantiene ampie informazioni relative alle modifiche normative e può fornire informazioni approfondite alla propria azienda in relazione a USP <659>. Sensitech fornisce anche supporto diretto sulle migliori pratiche per lo stoccaggio e il trasporto a temperatura controllata. Con oltre 20 anni di esperienza, Sensitech Professional Services conduce oltre 100 incarichi all’anno assistendo i clienti del settore farmaceutico nel migliorare le loro pratiche di archiviazione e distribuzione con dati reali utilizzando metodologie comprovate.
Puoi leggere di più sull’attuale documento USP <659> e sull’USP <1079> di prossima pubblicazione. Torna a leggere il prossimo blog di questa serie: USP <1079> Modifiche che devi conoscere.
Se desideri maggiori informazioni sugli studi di mappatura termica di Sensitech, visita il nostro sito dei Servizi professionali o contattaci.